
Na Química , distribuição eletrônica é a representação da quantidade de elétrons presentes em cada camada (ou nível de energia) de um átomo. Cada camada comporta uma quantidade máxima de elétrons.
Mas qual é o propósito desse estudo? A distribuição eletrônica ajuda a entender propriedades químicas e a reatividade dos elementos. Os elétrons na camada mais externa (camada de valência) são os mais importantes para a formação de ligações químicas. Compreender isso é fundamental para estudar a química de forma mais avançada, já que esse pode ser o primeiro passo para questões mais complexas.
Vem entender melhor o tema que é um clássico dos vestibulares!
+ 5 dicas para ir bem na prova de exatas do Enem!
Estrutura do átomo
Um átomo é composto por um núcleo, que contém prótons e nêutrons, e elétrons que orbitam ao redor deste núcleo. Os elétrons são organizados em camadas ou níveis de energia.
Veja só o esquema abaixo:

+ Tabela Periódica: consulte e aprenda a ler os elementos, períodos e grupos
Níveis de energia
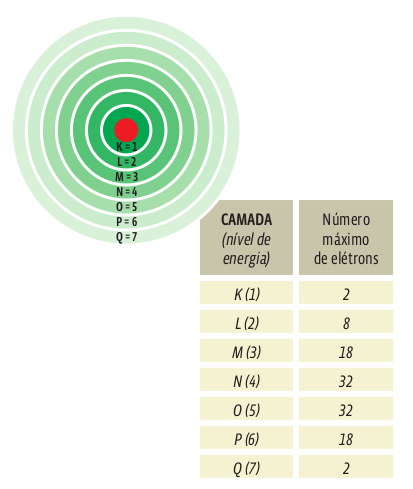
Os elétrons são distribuídos em diferentes camadas, que podem ser representadas por números quânticos (n). As camadas são numeradas a partir do núcleo:
1ª camada (n=1)
2ª camada (n=2)
3ª camada (n=3), e assim por diante.
Cada camada pode acomodar um número máximo de elétrons dado pela fórmula 2n². Por exemplo:
1ª camada: 2(1²) = 2 elétrons
2ª camada: 2(2²) = 8 elétrons
3ª camada: 2(3²) = 18 elétrons
As camadas também podem ser representadas pelas letras K, L , M, N, O, P e Q.
Subníveis de energia
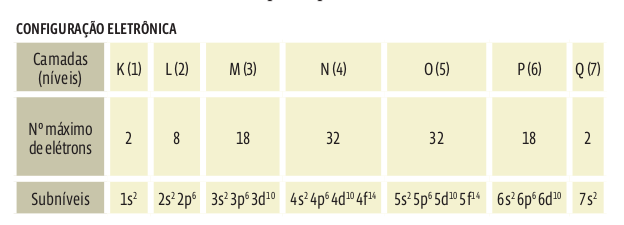
Dentro de cada camada, os elétrons estão organizados em subníveis, que são denominados s, p, d e f. Cada subnível tem uma capacidade específica:
Subnível s: 2 elétrons
Subnível p: 6 elétrons
Subnível d: 10 elétrons
Subnível f: 14 elétrons
Para entender a relação entre as camadas e subníveis, observe a tabela abaixo:
Princípio da Aufbau
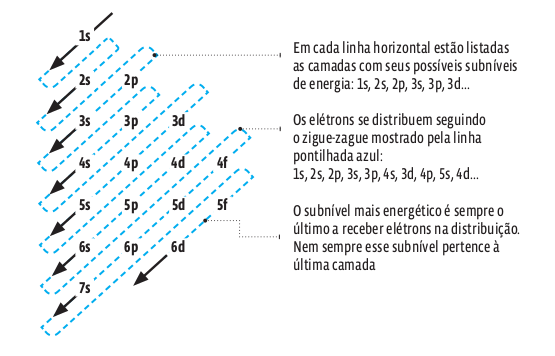
Os elétrons preenchem os subníveis de energia começando pelo de menor energia até os de maior energia. Isso é conhecido como o princípio da Aufbau. A ordem de preenchimento geralmente segue a sequência: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p.
Na hora de fazer a distribuição eletrônica de determinado elemento, utilize o diagrama de Linus Pauling:
Exemplo prático: Oxigênio (O)
O oxigênio tem 8 elétrons. Sua distribuição eletrônica é:
1s² 2s² 2p⁴
Isso significa que:
A primeira camada (1s) tem 2 elétrons.
A segunda camada tem 2 elétrons no subnível s (2s) e 4 elétrons no subnível p (2p).
Prepare-se para o Enem sem sair de casa. Assine o Curso GUIA DO ESTUDANTE ENEM e tenha acesso a todas as provas do Enem para fazer online e mais de 180 videoaulas com professores do Poliedro, recordista de aprovação nas universidades mais concorridas do país.
